目前,一些媒体和公众提出奥密克戎变异株导致的新冠等同于“大号流感”,我国是否需要借此时机改变防疫政策?
我们认为,目前中国坚持“外防输入、内防反弹”总策略和“动态清零”总方针是我国在特殊时期特定阶段选择的防疫政策,未来可能会根据疫情发展,药物获批等情况做出适当调整。但针对当前西方国家将奥密克戎导致的新冠等同于“大号流感”,实施与病毒共存的宽松政策,我国当下的情况不宜借鉴,原因有二:
1. 我国人群自然感染率远远低于西方国家,完全依靠接种疫苗建立的免疫屏障,而当前国内大规模接种的两剂灭活疫苗对奥密克戎变异株几乎没
有保护作用,虽说加强针可提升重症保护作用,但我国第三针加强针的接种率不高(41%),以上均是我国在免疫屏障方面存在的短板。
2.国内医疗资源不及欧美发达国家,如发生大面积感染入院,会产生难以承受的医疗压力。若演变出新的变异株,其传播性与危害性也无法预知。我们没有必要在此时全球疫情高峰时期改变政策敞开国门,可以静观西方“与病毒共存”政策的效果,结合未来新冠特效药在真实世界中的积极结果,再协调转变我国的防疫政策。
2. 新冠肺炎标准疗法
一、标准治疗方法
2021年12月由腾盛博药自主研发的中国首个新冠中和抗体联合治疗药物安巴韦单抗/罗米司韦单抗获批用于治疗轻型和普通型且伴有进展为高风险因素的成人和青少年患者(12-17岁,附条件获批),并且体外嵌合病毒实验检测数据表明,奥密克戎变异株易被安巴韦单抗/罗米司韦单抗联合疗法所中和。2022年2月,辉瑞的新冠治疗口服药物奈玛特韦片/利托那韦片组合包装(Paxlovid)附条件获批用于治疗成人伴有进展为重症高风险因素的轻至中度患者。两款药物的获批打破了国内无新冠治疗新药物的局面,并在第九版新冠诊疗方案中取代抗病毒的“老药新用”方案,成为轻型和普通型患者主要治疗措施。
目前获批的新冠特效药主要适应症为伴有进展为危重症风险因素的轻中症患者,对于身体素质较好的轻症患者,不推荐使用。新冠小分子特效药很可能和其他抗流感病毒的药物一样不会成为OTC, 未来对无症状感染者,疑似患者以及低风险的轻症感染者,可能依然采用中成药作为暴露后预防和治疗的措施。
中药及中成药治疗是中国新冠肺炎治疗的一个特色所在,国家中医药管理局认为使用中药可以在一定程度上降低死亡率、缓解患者症状,减少轻症、普通症患者转为重症患者。中国鼓励通过中西医结合治疗,为COVID-19提供新的治疗方案和思路。在疫情发生初期,武汉的轻中症患者方舱医院的隔离治疗中,中药复方是主要的治疗手段。但我们推测随着目前新冠特效药的上市和普及,中药或中成药的治疗地位可能将面临挑战,或将逐渐凭借价格优势可及性优势成为新冠小分子特效药的搭档用药。
重症和危重症患者,缺乏特效药可以使用,核心治疗策略以免疫抑制治疗+中药治疗+呼吸支持为主,而随着Omicron的流行,危重症患者的比例在减少,这部分市场并不大。
总体来看,中国获批的新冠新药物仍然相对缺乏,目前仅有2个新冠特效药获批上市。由于各国对新冠肺炎管控政策存在差异,中国始终坚持“动态清零”的方针,国内将长期面临境外输入压力,新冠疫情始终存在反复,国内仍然需要丰富新冠特效药物以应对新冠肺炎散点式爆发的风险。

图片来源:东吴证券
3.全球新冠药物研发现状
一、特效药辉瑞Paxlovid
(1)来源:Paxlovid包括PF-07321332与利托那韦胶囊两种药物成分。其中,PF-07321332是辉瑞自主研发的抗SARS-Cov-2多肽类药物,以3CL蛋白酶为靶点,可选择性地抑制病毒酶的活性。利托那韦本身对SARS-CoV-2没有抗病毒活性,但可以与肝药酶结合,从而防止PF-07321332在肝脏代谢中失活。2021年11月5日,公司公布II/III期中期分析数据,临床结果显示Paxlovid可降低89%的重症或者死亡风险。 12 月 22 日,辉瑞宣布新冠口服药 Paxlovid 的紧急授权申请(EUA)获 FDA 批准,成为美国首个获批的口服新冠药物。2022年 2月11日,中国NMPA附条件批准Paxlovid进口注册。
(2)靶点:冠状病毒主蛋白酶Mpro(3CL蛋白酶)
(3)结构:Paxlovid活性成分PF-07321332以SARS期间未上市的抗SARS病毒药PF-00835231为参考。PF-00835231是一个药物化学中的多肽类小分子药物,其富含氢键,具有极性表
面,无法被肠道吸收, PF-07321332通过系统化学修饰消除表面氢键供体,保证了该药物具有更好的口服生物利用度
(3) 机制:靶向3CL蛋白酶后抑制其活性,阻断新冠病毒增殖的过程
(4)优势:以病毒高度保守的3CL蛋白酶作为靶点,可有效应对病毒的变异;联用药物利托那韦有助于减缓PF-07321332的肝代谢,大大延长了药物活性成分PF-07321332 在体内的半衰期,增加其抗病毒的活性
(5)临床试验:根据Clinical Trial数据,Paxlovid在全球范围内共开设了4个III期临床,分别为NCT04960202 (2021年7月,全球)、NCT05011513(2021年8月,全球)、NCT05047601(2021年9月,全球)、NCT05261139(2022年3月,美国)。2021年11月, NCT04960202中期数据披露, Paxlovid可降低89%的重症或者死亡风险。
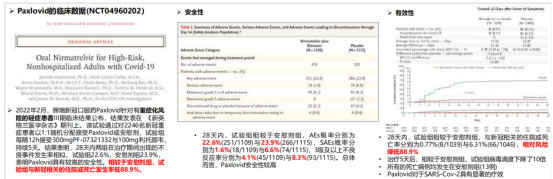
图片来源:东吴证券
二、默沙东Molnupiravir
(1)来源:Molnupiravir (MK-4482/EIDD-2801)为抗病毒核苷类抑制剂,由RidgebackBio研发,由默沙东合作负责全球开发。 2021年10月11日,基于3期MOVe-OUT临床试验计划内期中分析的积极结果,默沙东和Ridgeback宣布向美国FDA提交Molnupiravir的紧急使用授权申请。 2021年11月26日,默沙东官网披露Molnupiravir轻症III期的完整数据,结果表明与安慰剂相比,molnupiravir降低了30%的住院或死亡风险。11月4日,Molnupiravir 在英国获批上市,用于治疗轻至中度COVID-19成人患者。
(2)结构:Molnupiravir是一个NHC(β-D-N4-羟基胞苷)前药,经代谢后酯键水解后得到NHC。NHS为核糖核苷酸类似物,在病毒复制时取代正常的核糖核苷酸,从而阻止病毒的复制,但该药物不与任何靶点结合,不会阻止酶的作用
(3)机制:Molnupiravir作为一种非天然的核苷类抑制剂,可在SARS-CoV-2 RNA合成过程中作为反应物参与反应;Molnupiravir有两种互变异构体,分别可以与腺嘌呤(A)与鸟嘌呤(G)互补配对,从而给病毒RNA引入大量的突变,“瘫痪”病毒的基因组,有效抑制病毒的增殖
(4) 优势:口服单药治疗,具有广谱的抗病毒疗效
(5)临床试验:根据Clinical Trial数据,Molnupiravir在全球范围内共开设了3个III期临床,分别为NCT04575584 (2020年10月,全球)、NCT04575597 (2020年10月,全球)、NCT04939428 (2021年8月,全球) 。2021年10月11日, NCT04575597中期数据披露, molnupiravir降低了50%的住院或死亡风险,100%降低了死亡风险。2021年11月26日,NCT04575597 轻症III期的完整数据披露,Molnupiravir组有6.8%(48/709)的病人住院或死亡;安慰剂组有9.7%(68/699)的病人住院或者死亡;结果表明与安慰剂相比,Molnupiravir降低了30%的住院或死亡风险。

图片来源:东吴证券
三、新冠中和抗体
中和抗体是应对新冠肺炎的有效手段之一,目前全球已经有7个中和抗体获批或获得紧急使用授权,上市的中和抗体主要由欧美国家研发,亚洲目前只有2个,分别为韩国的
Regdanvimab单抗和中国的安巴韦单抗/罗米司韦单抗。中和抗体靶点明确,能精准的识别病毒的表面蛋白,阻断病毒进入细胞,安全性更好;中和抗体不仅可以阻断病毒,还可以迅
速提高免疫力,具有预防和治疗的双重作用。
SAR2-COV-2病毒高变异性为中和抗体开发带来了诸多挑战,针对容易突变的刺突蛋白,中和抗体的疗效仍然存在较大的未知数,针对保守表位开发抗体鸡尾酒疗法仍然是中和抗体应对病毒逃逸和变异最有效的设计手段,坚持走“预防+治疗”的路线,中和抗体仍然会占据一定的市场份额。
国产中和抗体蓄势待发,虽然目前仅有一个腾盛博药的安巴韦单抗/罗米司韦单抗鸡尾酒疗法获批,但已有4款中和抗体进入II期临床,还有多个中和抗体处于临床I期和临床前阶段。
安巴韦单抗/罗米司韦单抗是由腾盛博药与深圳市第三人民医院和清华大学联合开发的中和抗体,该抗体不仅通过基因修饰降低了抗体介导依赖性增强作用的风险,还延长了半衰期以获得更持久的治疗效果,是国内目前唯一一个应急获批的新冠特效药。国际三期临床对轻中度并伴有至少1个重症高危因素的门诊患者研究发现,安巴韦单抗/罗米司韦单抗治疗后住院/死亡率仅为2%,而安慰剂组为11%,风险降低80%,并且在症状出现0-5天和6-10天内治疗的疗效相似,基于上述良好的疗效和安全性,该中和抗体已向FDA提交EUA申请。
此外,安巴韦单抗与罗米司韦单抗分别结合刺突蛋白的不同位点,形成叠加效应,能更好的应对变异毒株引起的效力削弱的风险。体外嵌合病毒实验数据表明,安巴韦单抗/罗米司韦单抗联合疗法对“奥密克戎”和其他广受关注的新冠病毒变异株( 包括“德尔塔”和“德尔塔+”)均保持中和活性。除了治疗之外,安巴韦单抗/罗米司韦单抗用于新冠肺炎预防的使用值得期待,其超长半衰期的特点,为以后新冠暴露后和暴露前预防的临床研究(进行中)提供了基础,一旦获批“防+治”,其临床应用会进一步扩大。对于中和抗体,政
府采购将会是主要的销售渠道,目前针对政府进行战略储备和战略采购尚在推进之中。
国产另一个获批上市的中和抗体是君实生物的埃特司韦单抗(JS016),君实生物将其外权益授权给礼来,并与礼来的巴尼韦单抗组成鸡尾酒疗法用于治疗有进展为重症高风险因素的轻中度患者(包括成人,儿童,新生儿),但是由于对新型变异株奥密克戎失效,FDA已调整其适应症限制为仅用于暴露后感染或暴露于敏感变异株。君实另一个中和抗体JS026已
进入I期临床验证其单药以及与JS016鸡尾酒疗法的耐受性、安全性和药代动力学特征。临床前研究发现,JS026能阻断所有5种刺突蛋白RBD与ACE2受体的结合,IC50为0.6- 3.2µg/ml,在假病毒中和实验中JS026对主要流行的VOC毒株(贝塔、德尔塔等毒株)的ND50为5.6-10.8ng/ml。JS026与JS016分别靶向刺突蛋白的不同表位,能够协同发挥中和作用。对奥密克戎变异株中和实验中,JS026对真病毒的ND50为86ng/ml,JS026与JS016联合作用ND50仅为15.5ng/ml。在小鼠模型中,预防组中SARS-CoV-2病毒感染1天前接种JS026,肺部病毒RNA拷贝数明显低于对照组,5天后80%小鼠检测不到病毒;而在接种病毒1天后注射中和抗体,治疗5天后,JS026组40%在检测限以下,JS026+JS016组60%在检测限以下。鉴于此,未来JS026与JS016联合鸡尾酒疗法可能会成为应对新冠病毒极具潜力的中和抗体。
投顾姓名:陈定柱;投顾执业编号:A1120621060007;基金从业编号:A20250623005303
风险提示:以上内容仅供参考和学习使用,不作为买卖依据,投资者应当根据自身情况自主做出投资决策并自行承担投资风险。市场有风险,投资需谨慎!
免责声明:以上内容(包括但不限于图片、文章、音视频等)及操作仅供参考,我司为正规投资咨询经营机构,不指导买卖,不保证收益,投资者应独立决策并自担风险。






